富联代理
更多+怎么进行密码子优化?
原文首发于 BioFactory

撰文 |滴水同学
责编 | 留胡子的豆腐
在表达异源蛋白时,我们希望通过mRNA序列设计来提升外源蛋白表达的效率,诱导机体产生更多的中和抗体。mRNA序列设计,主要包括:密码子优化,5'UTR选择,3'UTR选择。这里面,最简单,最容易上手的便是密码子优化。今天这篇文章,以密码子优化作为主题,介绍基本的原则和操作方法:
- 为何密码子优化对蛋白表达非常重要?
- 密码子优化的基本原则
- 密码子优化的相关网站
- 密码子优化的操作步骤
大家知道构成蛋白质的常见氨基酸有20种,但是破译出来的密码子有64种(其中,3个终止密码子不编码蛋白质)回溯|谁破译了遗传密码,这就说明存在好几个密码子编码同一种氨基酸的现象,此种现象称为密码子简并性(Degeneracy),编码同一种氨基酸的几个密码子称为同义密码子(Synonymous Codon)。
对于一段特定的氨基酸序列,由于同义密码子的存在,可能存在难以计数的候选mRNA序列,但是在一个特定物种的特定细胞中,只能从无数可能的候选mRNA序列中选择一条mRNA序列来翻译出特定的氨基酸序列。不同的物种,不同的细胞,选择的候选mRNA序列是不同的,这是因为不同的物种,不同的细胞在编码同一种氨基酸时,选择的同义密码子是不同的(也就是密码子使用频率不同),具有各自的偏向性,此种现象称为密码子偏向性(Codon Bias)。
每一个宿主细胞会有一套自己的密码子使用频率表,一般来说,在宿主细胞里,使用频率高的密码子(最佳密码子),其对应的tRNA丰度高,由使用频率高的密码子组成的mRNA,其蛋白表达也会很高。异源mRNA的密码子和宿主细胞的最佳密码子使用频率存在偏差,可能会出现异源蛋白mRNA序列里密码子对应的tRNA丰度在宿主细胞中非常低的,此低丰度的tRNA对应的密码子在宿主细胞中稀有密码子(Rare Codon),稀有密码子会导致核糖体花费很多时间才能找到匹配的低丰度的tRNA,从而导致核糖体在mRNA上的停滞不前,甚至引起mRNA降解。因此异源蛋白表达需要进行密码子优化,选择高丰度的tRNA对应的同义密码子,提升蛋白翻译效率。
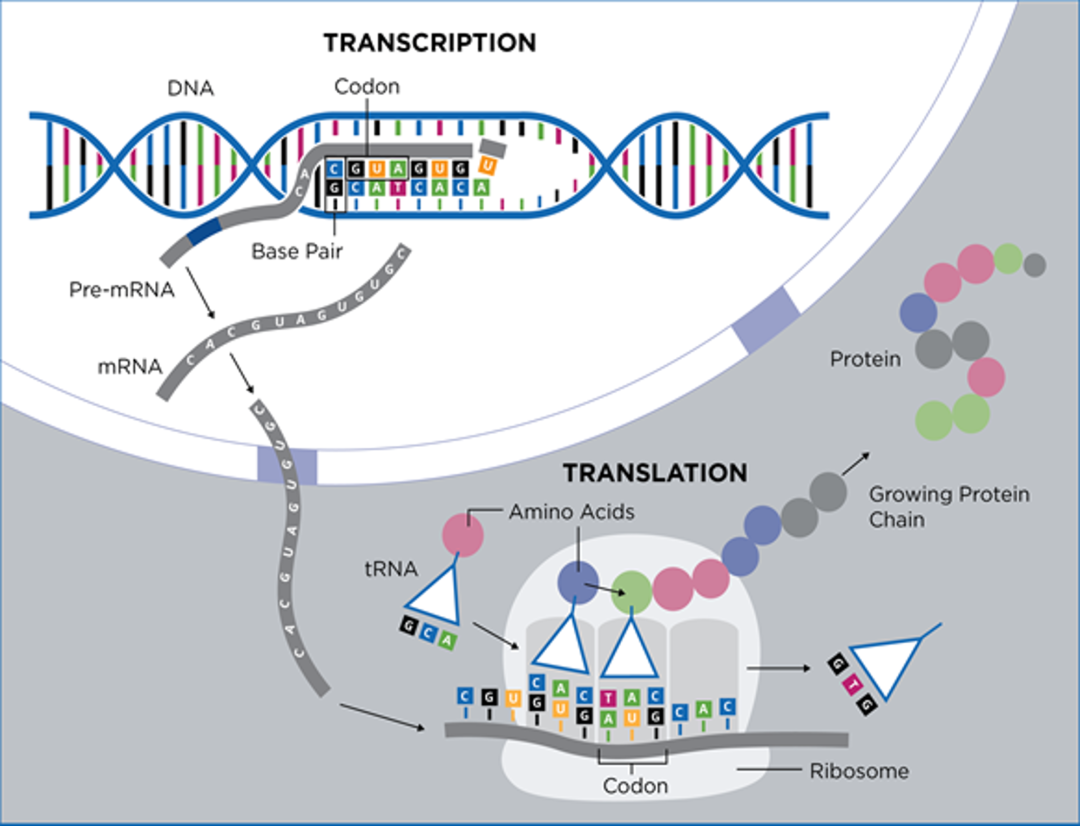
密码子适应指数CAI (Codon Adaption Index ),指异源mRNA序列中密码子和宿主细胞最佳密码子使用频率的相符程度,此数值越接近1,理论上,外源mRNA在宿主细胞中的蛋白表达越高。因此密码子优化最基本的原则就是用宿主细胞中使用频率高的同义密码子去替换外源mRNA序列中的密码子,保证外源mRNA序列中的密码子和宿主细胞的密码子使用偏向性更加契合,避免出现稀有密码子。但是,我们需要知道,密码子并不是影响蛋白表达的唯一因素,还存在其他因素,例如稀有密码子,GC含量,二级结构(自由能)等。
当把外源mRNA序列中的密码子全部更换为宿主细胞的最佳密码子,可能反而导致蛋白无法表达,因为由一些蛋白的表达需要稀有密码子的存在,延缓核糖体前进的速度,为蛋白质的正确折叠来提供足够的时间。
在2006年,Grzegorz Kudla等人发表文章High Guanine and Cytosine Content Increases mRNA Levels in Mammalian Cells,发现在哺乳动物细胞中,富含GC的基因表达效率要比低GC含量的基因高出几倍到一百倍,这种现象是由于富含GC的基因更加高效的mRNA转录或者加工,产生更多的处于稳定状态的mRNA。
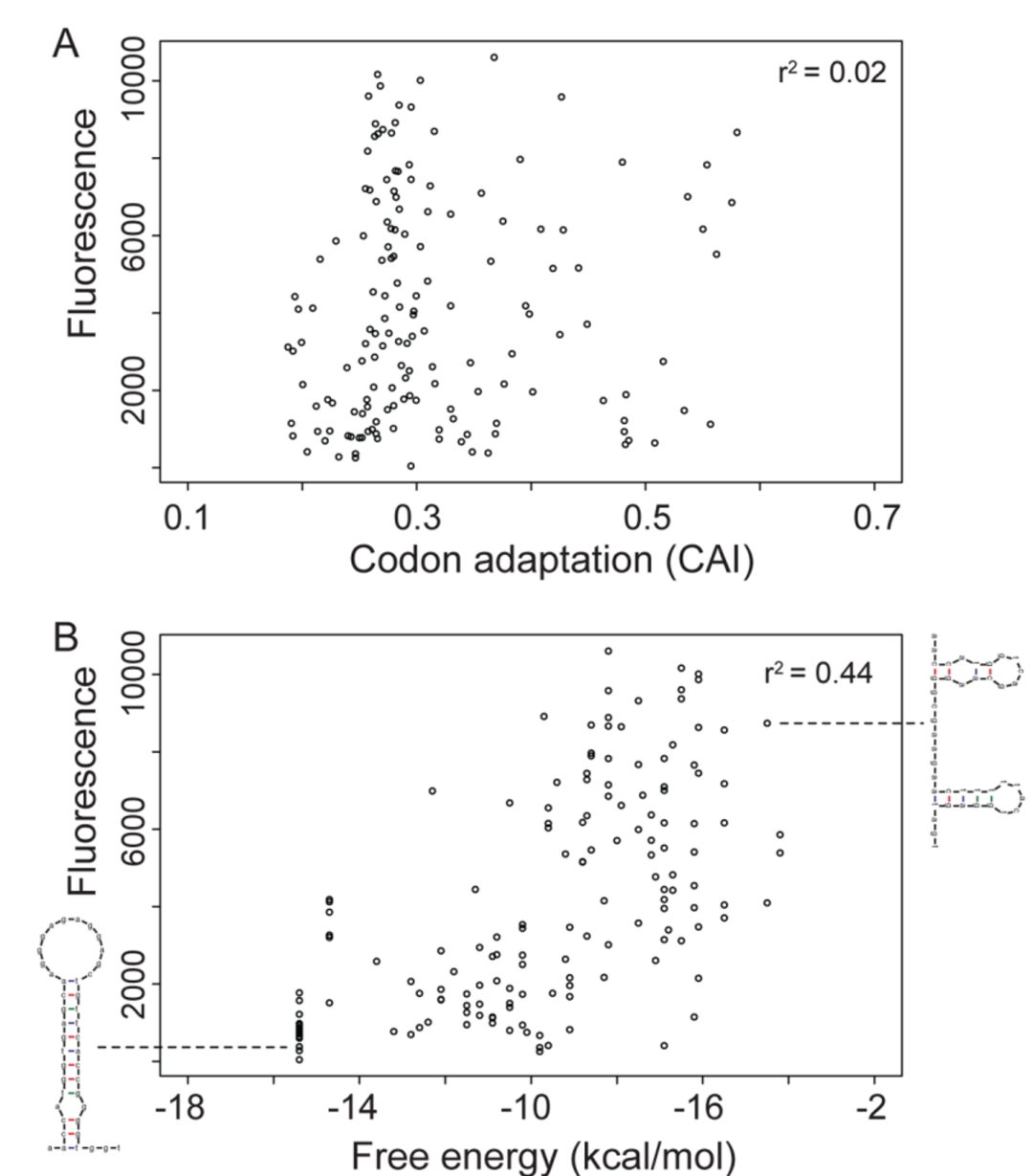
在2009年,Grzegorz Kudla等人在Coding-sequence determinants of gene expression in Escherichia coli 中,构建了154个同义密码子随机突变的GFP mRNA,将其置于相同的启动子下,研究同义密码子突变对蛋白表达的影响。结果发现,表征GFP蛋白表达的荧光信号和CAI的相关性没有那么强,有些GFP mRNA的表达荧光信号很高,但是CAI很低。GFP mRNA 5'端的折叠自由能(the folding energy)和GFP蛋白表达的荧光信号有极强的相关性,高表达的GFP mRNA 5'端起始密码子附近的结构包含有很多未配对的核苷酸,折叠自由能低;低表达的GFP mRNA 5'端形成一个典型的长发卡结构,折叠自由能高,对蛋白翻译起始造成了限制(翻译起始时蛋白表达的限速步骤)。
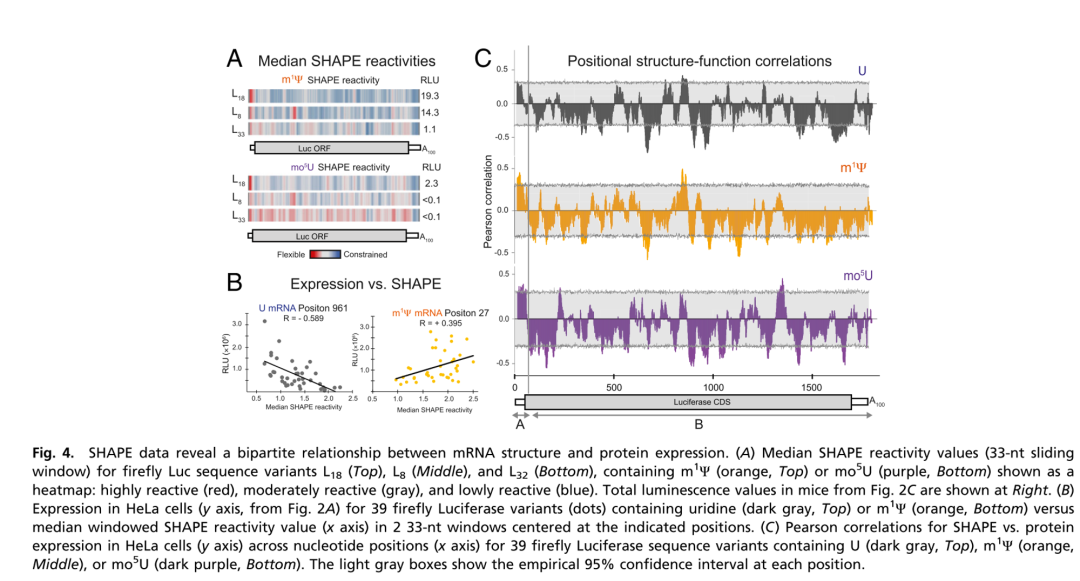
在2019年,David M. Mauger等人发表文章 mRNA structure regulates protein expression through changes in functional half-life,证实mRNA 5'端UTR+CDS区域前十个密码子形成的二级结构越少,其编码的蛋白表达量越高,剩余的CDS区域+3'端UTR形成的二级结构越多,其编码的蛋白表达量越高(SHAPE活性越高表示RNA二级结构越少,也就是越松弛)。
当前主流的密码子优化网站基本主要以优化CAI作为指标,主要有:
- https://www.vectorbuilder.cn/tool/codon-optimization.html
- http://genomes.urv.es/OPTIMIZER/
- https://climsprod.genewiz.com.cn/Toolbox/CodonOptimization
- https://www.genscript.com/tools/gensmart-codon-optimization
- http://www.jcat.de/
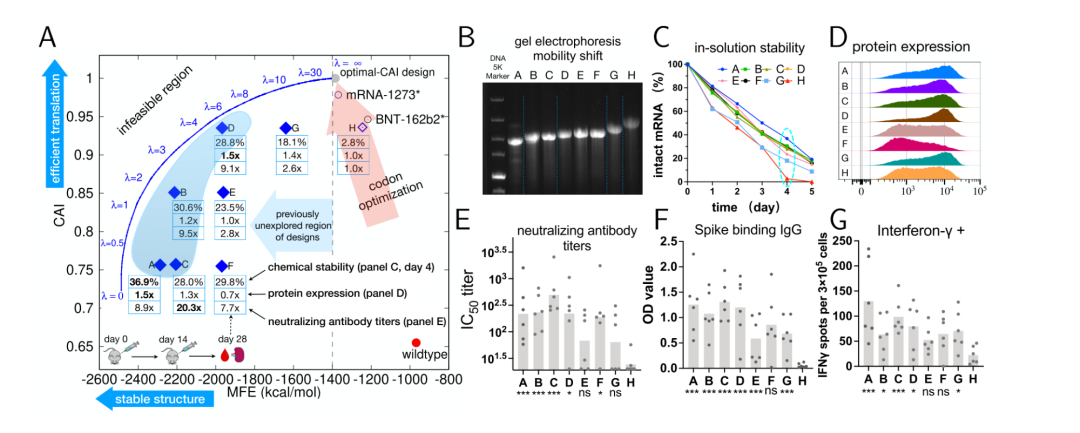
2021年10月,张贺等人发表文章LinearDesign: Efficient Algorithms for Optimized mRNA Sequence Design,开发了一种新的算法来更加有效地优化mRNA序列,网站http://rna.baidu.com/,算法兼顾了mRNA的密码子适应指数CAI和折叠自由能MFE,能够获得结构更加稳定的mRNA,延长mRNA半衰期和蛋白表达时间,从而提升细胞内mRNA终产量。
用新冠Spike蛋白来举例说明,横坐标表示每一种氨基酸对应的同义密码子数量,SARS-CoV-2 Spike蛋白总共有1273个氨基酸(包括终止密码子),那么计算得到2.4×10^632种可能的mRNA序列;纵坐标表示密码子在宿主细胞中出现的频率,粉红色的线,表示野生型的mRNA序列;黑色的虚线表示构成该mRNA序列的所有密码子是由宿主细胞中出现频率最高的同义密码子组成(最佳密码子适应指数CAI);蓝色的线表示该mRNA序列的自由能最小,稳定性最高。
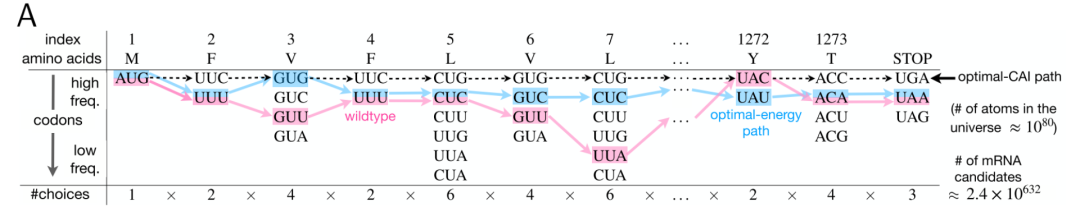
该文章认为,当前传统密码子优化软件算法只能挖掘到橘色箭头覆盖区域的候选mRNA序列,此区域内的mRNA序列同野生型的Spike蛋白mRNA序列相比,CAI获得极大的提升,但是MFE并无太大改变,也就是mRNA结构稳定性未获得实质提升。而LinearDesign可以发掘传统密码子优化软件未曾发掘到的蓝色区域,MFE减少,mRNA结构稳定性获得极大提升,这样带来的一个结果是,在兼顾CAI的条件下,mRNA在细胞内表达持续的时间会更长,从而产生更多的S蛋白,诱导机体产生更多的抗体。
目前LinearDesign 百度研发小组已经同各大药企展开合作,对于单个mRNA的优化价格也在商讨议定中,据笔者和研发人员沟通的信息来看,如果有意向展开合作,百度RNA研发小组愿意提供免费优化,感兴趣的朋友可以尝试联系(RNA微信群成员中也有百度RNA研发老师在里面)。
密码子优化一般以氨基酸序列作为原始序列,首先我们需要计算原始氨基酸序列在宿主细胞中的密码子适应指数CAI(http://www.detaibio.com/tools/),一般来说,CAI在0.7以上,蛋白表达都可以较好地进行。然后,我们将原始氨基酸序列输入密码子优化的相关软件可能获得更高CAI指数的mRNA序列(相比原始氨基酸序列)。传统密码子优化算法,有的也会兼顾GC含量,二级结构等,但是总体是以CAI作为最重要的指数。如果想要获得结构上更好的提升,建议尝试Lineardesign。网上相关的密码子优化软件很多,可以选用几个不同算法的软件,获得几个不同的优化序列,然后转染细胞,比较实际表达效果。
目前对mRNA序列进行密码子优化,只能借助于网上一些开源的密码子优化软件,并无其他更好的方法,实际上是一种非常鸡肋的做法,并无多少确定性可言,只能看运气。期待未来可以构建一个类似 cell free synthesis算法系统,可以将优化过的候选mRNA序列直接丢进cell free synthesis算法系统中,给出一个模拟的表达量。类似的功能,小熊猫生物已经实现,他们推出了一个超高通量的测试原核载体表达平台,客户可以快速测试蛋白在不同载体以及不同调控元件下的表达量。未来mRNA序列的优化(密码子优化,5'UTR,3'UTR)必将依靠算法系统去解决,只有如此才可以更加迅速有效地获得理想的mRNA序列。
BioFactory留胡子的豆腐 出品
个人转载内容至朋友圈和群聊天,无需特别申请版权许可。
请相信:21世纪是生物的世纪,然而,这和你并没有太大的关系
今天给大家翻译的是2015年《CELL》期刊文章:Codon optimality is a major determinant of mRNA stability。
密码子的使用既在翻译水平上影响基因表达,也在mRNA衰退水平上影响基因表达,最佳和非最佳密码子之间的平衡有助于微调mRNAs水平,并最终影响蛋白质水平。
信使RNA降解是基因表达的关键调控步骤。虽然已经确定了转换的主要途径,但对不同半衰期的解释仍然难以捉摸。我们发现密码子最优性是对mRNA稳定性有很大贡献的一个特征。全基因组RNA衰变分析表明,稳定的mRNA富含最佳密码子,而不稳定的mRNA则主要含有非最佳密码子。将最佳密码子替换为同义的非最佳密码子会导致mRNA的不稳定,而相反的替换会显著增加稳定性。此外,我们证明了密码子最优性影响核糖体易位,通过密码子最优性连接翻译延伸和降解过程。最后,我们表明,最佳密码子含量解释了在编码具有协调生理功能的蛋白质的mRNA中观察到的类似稳定性。这项工作表明,密码子优化作为一种机制存在,以微调mRNA水平,并最终调整蛋白质。
信使RNA (mRNA)降解在调节细胞转录水平中起着关键作用,并且是调节基因表达的主要控制点。酿酒酵母中大多数mRNA的降解起始于去除3'聚腺苷酸尾(去腺苷酸化),随后切割5' 7mGppN帽(脱帽)和mRNA体在5'-3'方向的外切核酸降解。尽管被共同的降解途径靶向,但单个酵母mRNAs的周转率显著不同,半衰期从<1分钟到60分钟或更长。长期以来一直在寻找影响转录物稳定性的RNA特征,并且位于5'和3'非翻译区(UTR)内的一些序列和/或结构元件已被认为有助于mRNA子集的降解。然而,这些特征主要通过调节因子的结合以转录本特异性的方式调节mRNA的稳定性,并且不能解释在整个转录组中观察到的半衰期的广泛变化。因此,似乎有可能在mRNAs中存在调节转录稳定性的额外的和更普遍的特征。
我们之前已经表明,在报告基因mRNA的开放阅读框架(ORF)内包含一簇稀有精氨酸密码子显著增强了其周转。稀有密码子引起的mRNA去稳定化表现为转录物去腺苷酸化和脱帽的增强。这种效应不依赖于RNA监测途径,如 No-Go, Nonsense-Mediated或Non-Stop降解。稀有密码子和报道mRNA的增强的mRNA周转率之间的联系与早期对酵母中几种内源性转录物的观察一致。
我们以前的研究中使用的稀有密码子属于被定义为非最佳密码子的一般类别。从概念上讲,密码子最佳性是反映细胞质池中带电tRNA分子的供应与翻译核糖体对tRNA使用的需求之间的平衡的尺度,代表了翻译效率的衡量标准。关键的是,最佳密码子被假设为比非最佳密码子更快、更准确地被核糖体解码,后者被假设为减缓翻译延伸。因此,密码子的最佳性被假设在调节翻译延长率和蛋白质合成动力学中发挥重要作用。在这项工作中,我们提出了四条证据来支持这一发现,即密码子的最佳性对酵母细胞中的mRNA稳定性有广泛而强大的影响。首先,对RNA衰减率的全局分析表明,信使核糖核酸半衰期与最佳密码子含量相关。许多稳定的mRNAs表现出强烈的偏好在其编码区中包含最佳密码子,而许多不稳定的mRNAs含有非最佳密码子。其次,我们证明了用同义的、非最佳的密码子替换最佳密码子会导致mRNA的显著不稳定,而相反的替换会导致mRNA稳定性的显著提高。第三,我们通过实验证明了密码子优化对核糖体易位的影响,表明对mRNA衰变的影响是通过调节mRNA翻译延伸发生的。这些发现表明,由密码子使用决定的转录特异性翻译延伸速率是mRNA稳定性的重要决定因素。第四,我们观察到编码具有共同生理功能的蛋白质的基因中紧密协调的最佳密码子含量。我们假设这一发现解释了先前观察到的这些基因家族mRNA衰减率的相似性。总之,我们的数据表明,在蛋白质合成和mRNA降解的水平上,蛋白质编码区存在协调基因表达的进化压力。
使用从总RNA样品中富集polyA+ RNA的方法和/或使用退火到poly(A)尾的寡核苷酸合成互补DNA (cDNA)的方法来测量总体mRNA衰减率,可能由于几个原因而不能捕获重要信息。虽然已经确定去腺苷酸化是mRNA更新的限速步骤,但是我们和其他人已经观察到特定的mRNA在细胞中作为“稳定的”去腺苷酸化物质持续存在。对于这样的转录物,脱帽和随后的降解被延迟,脱帽成为mRNA降解的速率决定步骤。此外,一些mRNAs可能包含阻碍poly(A)尾功能的结构。最后,由于去腺苷酸化过程将mRNA种类从能被oligo dT有效捕获的种类转化为不能被oligo dT有效捕获的种类,获得的信息的总体水平可能随着所用方案中达到的poly(A)富集水平而变化。考虑到这一点,我们试图确定这些现象在转录组水平上有多普遍。为此,我们在RNA聚合酶II失活后进行了时间进程研究。在每个时间点,从oligo-dT选择的mRNA或rRNA缺失的全细胞RNA制备文库,并进行Illumina测序(参见实验程序)。这种方法允许我们比较poly(A)半衰期(oligo dT)与总mRNA衰减率(rRNA耗尽;图1A)。值得注意的是,当分析rRNA耗尽的文库时,相对于从poly(A)选择的文库确定的半衰期,我们可以有把握地计算半衰期(3969)的绝大多数(92%)转录物具有更长的半衰期(图1B和C)。值得注意的是,并非所有这些转录物都以去腺苷酸化RNA的形式存在,因为具有短poly(A)尾的mRNAs不会结合寡dT。这些数据表明,由寡dT选择确定的mRNA半衰期给出了高度偏斜的值。例如,当从poly(A)选择的RNA测定时,ADH1 mRNA具有4.2分钟的计算半衰期,当从rRNA耗尽的RNA测定时,具有31.7分钟的半衰期(完整列表见S1表)。
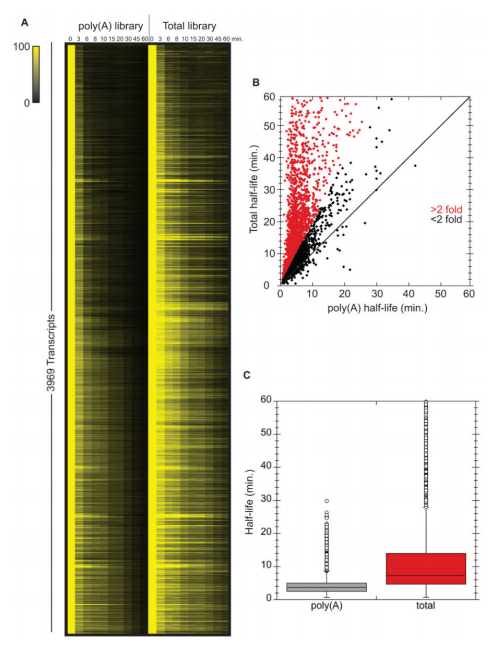
(A)在两个文库中具有可靠半衰期的所有mRNAs都被可视化作图。颜色强度代表剩余的标准化mRNA(对于每种mRNA,时间0设置为100%)。(B)根据总mRNA测序相对于poly(A)测序计算出的每种mRNA的半衰期。差异超过2倍的数据点以红色突出显示。(C)两个图书馆的半衰期分布概况。另见表S1。
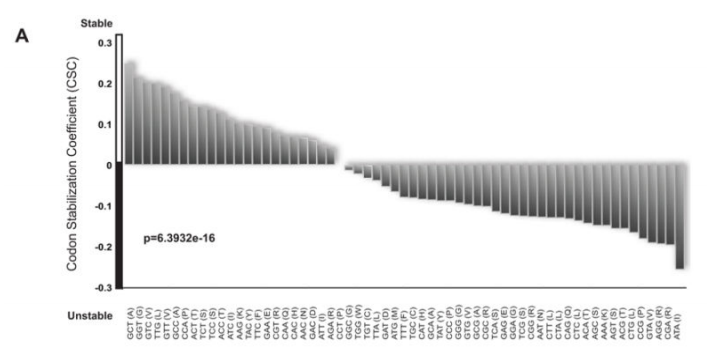
有了这些数据,我们试图识别可能决定稳定性或不稳定性的序列基序,但没有成功。跟进之前的观察,即在原本稳定的mRNA的开放阅读框中包含10个连续的稀有密码子会导致稳定性的急剧下降,我们检查了我们的转录组范围的mRNA半衰期数据,以确定ORF内的密码子含量是否会影响mRNA的稳定性。为了做到这一点,我们确定了富含任何单个密码子的mRNAs是否表现出更大或更小的稳定性。我们将信使核糖核酸定义为稳定的,如果它们的半衰期比平均值长2倍以上(~20分钟),而不稳定的,则如果它们的寿命小于平均值的一半(~5分钟)。对于每个密码子,我们计算了该密码子在mRNAs中出现的频率与mRNAs稳定性之间的相关性。将一个密码子的出现与每个mRNA的半衰期进行比较,并使用皮尔逊相关性计算产生R值(图S1E中以图形方式表示样本密码子)。我们将这一指标称为密码子出现率与mRNA稳定性相关系数(CSC)。然后将所有密码子的CSC值相互比较(图2a)。值得注意的是,观察到一些密码子优先出现在稳定的mRNAs中,而另一些密码子优先出现在不稳定的mRNAs中(总p值=1.496e-14,排列p值<10 -4)。例如,根据我们的RNA-SEQ分析,GCT丙氨酸密码子在稳定的转录本中高度丰富,而其同义密码子GCG和GCA优先出现在不稳定的转录本中(图2A)。大约三分之一的密码子三联体在稳定的mRNAs中过度表达,而其余三分之二似乎在不稳定的mRNAs中占优势。由于大量的数据集和观察到的相关性的重要性,这些数据强烈表明密码子的使用影响mRNA降解率。
几十年来,大量文献假设某些密码子的翻译效率可能比其他的更高。Reis等人提出了一种衡量密码子翻译效率的方法,并将其命名为tRNA适应性指数(tAI)。这一指标旨在反映核糖体利用tRNA的效率。术语密码子优化性已被引入以试图定义翻译装置对密码子的差异识别。Frydman及其同事一般将任何阿泰高于0.47的密码子定义为最优,将任何阿泰低于0.47的密码子定义为非最优(图2B)。他们对密码子的最终命名也考虑了基因组中某些密码子的过度表达和表达不足,称为密码子偏好性(图2B;标有*)。因此,密码子优化在某种程度上反映在基因组密码子使用中(图S1A);然而,常见的密码子可以是最佳或非最佳的,而不常见的密码子也可以是最佳或非最佳的(图S1B)。引人注目的是,与稳定或不稳定mRNAs相关的密码子分别几乎完美地反映了它们的最优或非最优分配(图2C)。
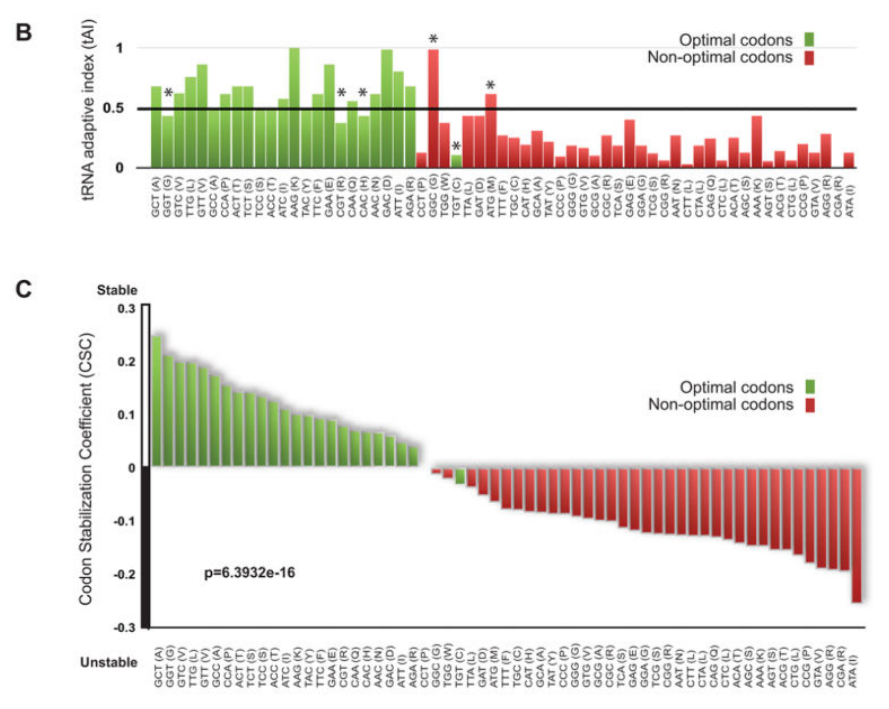
(B)以与(A)相同的顺序绘制的每个密码子的tRNA适应性指数值。Pechmann和Frydman (2013)中定义的密码子优化是用颜色编码的,绿色代表最佳密码子,红色代表非最佳密码子。根据其中讨论的附加标准,标有星号(*)的密码子被称为最优或非最优。
(C)如在(A)中为每个密码子绘制的密码子出现与mRNA稳定性相关系数(CSC ),但是在(B)中呈现的优化信息通过颜色编码添加。绿色代表最佳密码子,红色代表非最佳密码子。
我们的CSC指标和tAI之间的直接比较揭示了这些值之间非常好的总体一致性(图2D;R=0.753,p值=2.583e-12,置换p值< 10 -4)。
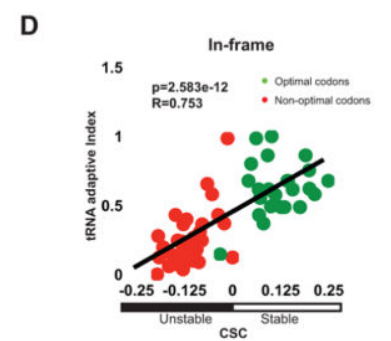
重要的是,最佳密码子含量和mRNA半衰期之间的关系与用于确定半衰期的方法无关。我们使用Miller等人获得的mRNA衰变率,重复了我们对密码子使用与mRNA半衰期的分析。与我们自己的相比,这些数据是通过使用代谢标记的稳态方法计算获得的,代谢标记对细胞的干扰最小,与我们的方法完全不同。两个数据集都显示了最佳密码子含量和mRNA衰减率之间相似且惊人的相关性(图S1C和D)。
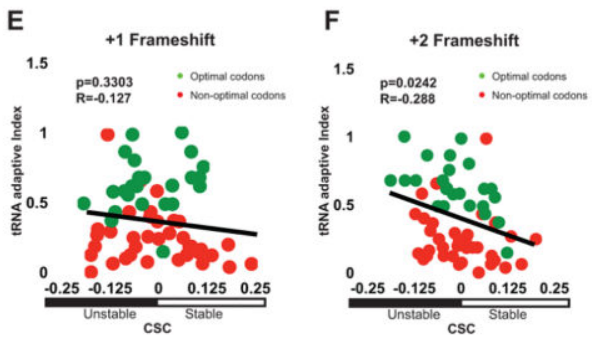
为了确定密码子优化相关性是否可能掩盖了实际上可能决定mRNA半衰期的其他特征(例如序列含量、GC百分比或二级结构),我们在通过计算引入+1和+2移码后重新分析了我们的数据。在这些移码ORF的分析中,密码子含量和稳定性之间的相关性完全消失,从而消除了其他具有决定性的变量(图2E;R=?0.127,p值=0.3303,排列p值=0.8847和图2F;R=?0.288,p值=0.0242,排列p价值=0.0012)。
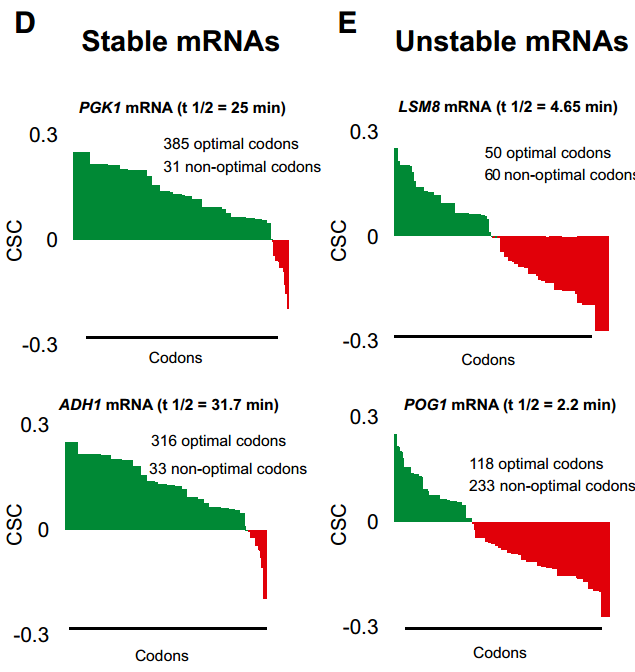
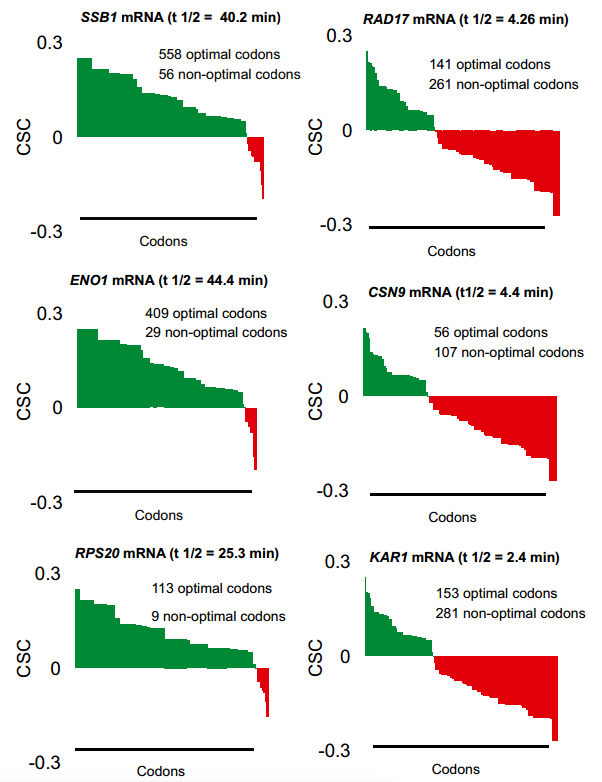
如上所示,我们的总mRNA稳定性数据的计算分析揭示了密码子出现和mRNA半衰期之间的关系。这些数据表明,或者是特定的密码子改变了稳定性,或者是mRNA中的整体密码子含量共同影响了稳定性。为了在个体转录物水平上评估最佳密码子含量和衰变率之间的关系,对所有个体转录物的密码子使用进行作图(图S2)。聚类分析显示,不同的mRNAs偏向于使用不同类型的密码子。总的结果并不令人惊讶,因为密码子偏好性已经得到了很好的研究;然而密码子使用的模式表明某些类别的mRNAs主要使用最佳或非最佳密码子(图3A和B;代表过多的密码子用黄色表示,代表不足的密码子用蓝色表示),并且这种用法与总体转录物稳定性相关(图3C)。对几个稳定的mRNAs的更仔细的检查揭示了这些转录物不富含任何特定的密码子,但是绝大多数比例(> 80%)的密码子属于最佳类别(图3D)。相比之下,发现单个不稳定的mRNAs在非最佳密码子中富集(60%或更多)(图3E)。这些分析表明,在这组mRNAs中,稳定的mRNA偏向于包含占优势的最适密码子,而不稳定的mRNA富含非最适密码子,尽管特定的密码子同一性在各个转录本之间有所不同。
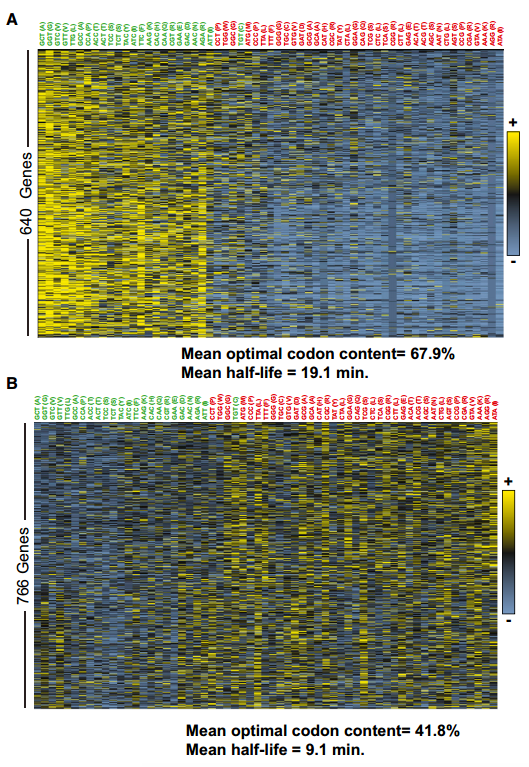
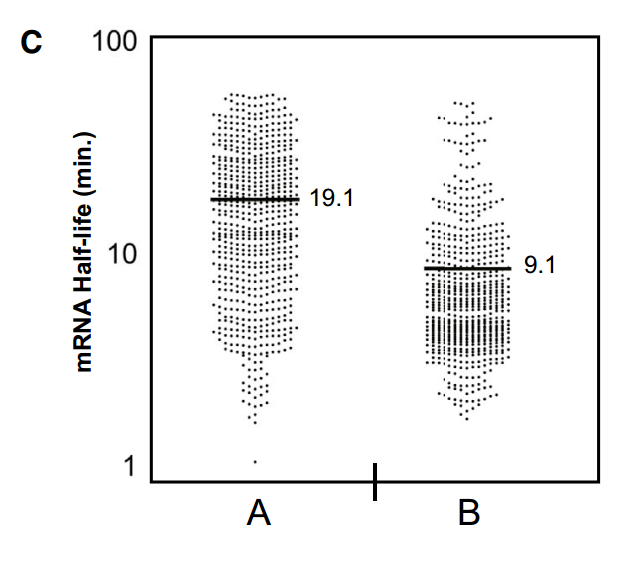
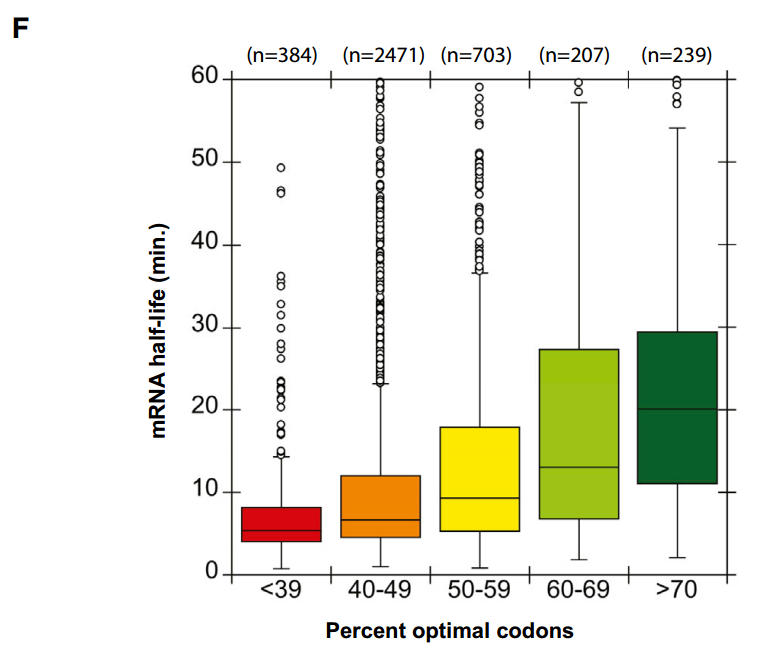
将该分析扩展到整个转录组的水平,当用百分位数评估mRNA中最佳密码子的比例时,观察到最佳密码子含量和mRNA稳定性之间的相关性。具体来说,具有少于40%最佳密码子的mRNAs通常被发现是不稳定的,平均半衰期为5.4分钟。相反,发现具有70%或更高最佳密码子含量的mRNAs是稳定的,中位半衰期为17.8分钟(图3F)。
为了在实验上验证计算分析中观察到的关系,我们评估了改变mRNA中最佳密码子百分比对稳定性的影响。我们通过对60个非最佳密码子中的52个进行同义最佳替换来修饰不稳定的LSM8 mRNA(半衰期=4.65分钟)的密码子含量。类似地,我们用同义的非最佳密码子替换了稳定RPS20 mRNA(半衰期=25.3分钟)编码区内的大多数最佳密码子(113个中的108个)。该方法确保由这些序列编码的多肽与天然形式相比没有变化。此外,选择取代以避免显著改变编码区的GC含量或引入任何预测的RNA二级结构(数据未显示)。转录抑制后这些mRNAs的Northern印迹分析显示,这两个转录物中密码子的改变导致其稳定性的显著变化。具体而言,由于非最佳密码子在其ORF中转化为同义最佳密码子,LSM8 mRNA的半衰期增加了7倍以上(半衰期=18.7分钟;图4A)。相反,在稳定的RPS20 mRNA中用非最佳密码子替换最佳密码子导致其稳定性急剧降低(10倍)(半衰期=2.5分钟;图4B)。这些数据表明,mRNA中密码子的同一性可以强烈影响稳定性,并且最佳密码子含量对决定体内mRNA的衰减速率有显著贡献。
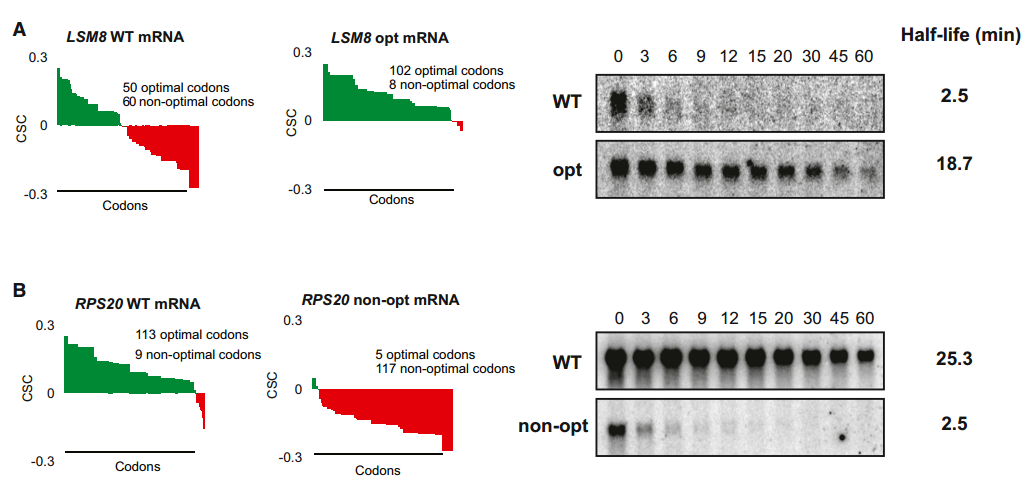
(B)如(A)所述,除了自然最优的信使核糖核酸外,RPS20(如图3D所示)已被设计为比RPS20非OPT更低的最佳性。RPB1-1关闭实验的Northern斑点显示在右侧,两个消息的半衰期都是如此。量化归一化为SCR1加载控件(未显示)。
为了进一步检验最佳密码子含量和mRNA稳定性之间的关系,我们产生了两个合成的开放阅读框,它们编码相同的59个氨基酸多肽,但在每个密码子的最佳性上不同(SYN报告子;图S3A、B和C)。我们将合成的ORF引入带有MFA2的5'和3'UTR的报道基因中,MFA2是一种被充分研究过的mRNA,它在细胞中被迅速降解(半衰期=3.0分钟),这种现象部分地被其3'UTR内编码的元件介导。我们还将合成的ORF引入具有PGK1的5'和3' UTR的报道基因中,PGK11是一种特征明确且稳定的mRNA(半衰期=25分钟)。当通过转录关闭分析测量四种报道基因mRNAs的稳定性时,发现编码最佳SYN ORF的转录物比它们携带非最佳密码子的对应物明显更稳定(约4倍)(图4C)。
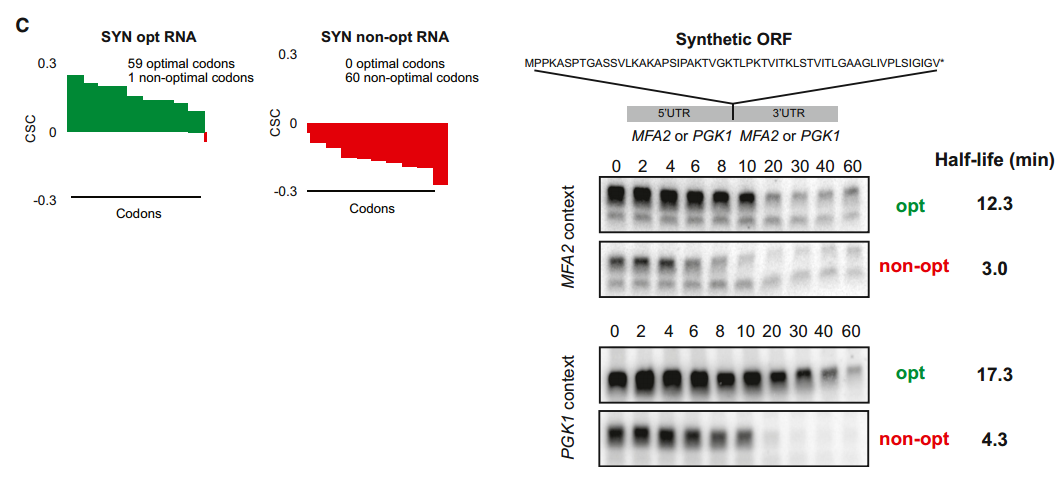
肽是人工设计的,与任何已知的蛋白质都没有相似之处。SYN opt和non-opt都是从稳定转录本(PGK1)和不稳定转录本(MFA2)插入到侧翼区域。右侧的Northern blots显示GAL关闭实验,表明SYN mRNA在MFA2和PGK1侧翼序列中具有稳定性。定量归一化为未显示的SCR1加载控制。另请参见图S3。
重要的是,最佳和非最佳编码的SYN报道基因mRNA的降解被确定为通过用于降解酵母中大多数内源mRNA的去腺苷化依赖性脱帽途径发生,而不是由已知靶向异常mRNA的三种途径中的任何一种介导(图S3G和H)。对这些mRNAs衰减的高分辨率northern分析证实,正常衰减途径中受调节的步骤去腺苷酸化和脱帽速率受到报道基因ORF内密码子组成变化的影响(图S3D、E和F)。这些数据表明,最佳密码子含量是mRNA稳定性的关键决定因素,影响mRNA转换过程中的去腺苷化和脱帽速率,而不依赖于5'和3' UTRs,它们可以平行作用以稳定或去稳定mRNA。
为了评估密码子优化对体内mRNA翻译效率的影响,我们产生了三种新的报道基因,它们在最佳密码子含量上不同,但在氨基酸序列上没有差异。具体而言,我们改造了HIS3基因的ORF,使其包含所有最佳密码子(HIS3 opt)或所有非最佳密码子(HIS3 non-opt),野生型HIS3基因在43%最佳密码子处提供了一个中间点(图5A)。选择HIS3基因是因为与我们的其他同义突变构建体相比,它具有相对长的ORF (220个氨基酸),允许我们通过蔗糖密度梯度有效地监测核糖体结合(见下文)。然后,我们使用rpb1-1菌株通过转录关闭分析确定了三个HIS3构建体的mRNA衰减率。与我们之前的结果一致,观察到改变最佳密码子含量对mRNA半衰期产生显著影响(图5B)。值得注意的是,对HIS3 mRNA衰减的影响与使用的最佳密码子的百分比相匹配。最佳构建体的半衰期(半衰期> 60分钟)比野生型构建体(半衰期=9.5分钟)长得多,野生型构建体的半衰期明显长于非最佳构建体(半衰期=2.0分钟)。因此,我们可以通过改变最佳密码子含量,在不改变蛋白质序列或侧翼序列的情况下,在酵母中实现全范围的mRNA半衰期改变。
我们假设密码子优化会影响翻译延伸。我们用两种方法测试了这个假设。首先,我们通过western blot监测HIS3最佳构建体与HIS3非最佳构建体的蛋白质产量,然后将蛋白质表达标准化为mRNA水平,如northern blot所确定的。我们观察到非最佳构建体的蛋白质产量比最佳构建体低四倍(图5C)。其次,我们评估了HIS3 mRNA结构上的核糖体密度。使用蔗糖梯度监测核糖体密度,然后对分离的级分进行分级和northern印迹。关键的是,观察到所有三种HIS3报道基因mRNAs的核糖体占据率几乎相同(图5D)。因此,我们认为,蛋白质产量减少四倍,同时在多聚核糖体中的定位几乎相同,这表明与最佳构建体相比,非最佳构建体的核糖体易位率降低。
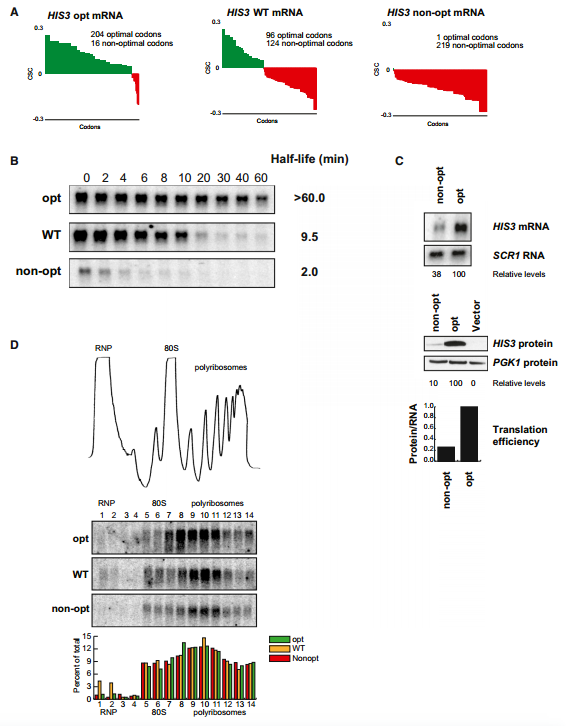
(B)rpb1-1关闭实验的Northern印迹显示了所有三种信息的半衰期。定量归一化为SCR1;加载控制未显示。
(C)最佳和非最佳版本HIS3的稳态浓度的Northern和Western印迹。加载控制和定量如下所示。翻译效率计算为相对蛋白质水平除以相对mRNA水平,并在底部绘制。对数字数据扫描进行处理,从单个凝胶图像中去除不相关的通道。
(D)微量蔗糖密度梯度分析,以及梯度组分的northern blot分析。印迹显示了三个HIS3报告基因在梯度内的位置。每个分数的定量如下所示。
为了直接确定核糖体在含有非最佳密码子和最佳密码子的mRNAs上转运是否较慢,我们监测了这两种报告基因的核糖体流失。为此,我们通过剥夺细胞葡萄糖10分钟来阻断翻译起始。葡萄糖剥夺导致翻译起始的快速抑制,因此大量多聚核糖体因流失而丢失(图6A对C)。
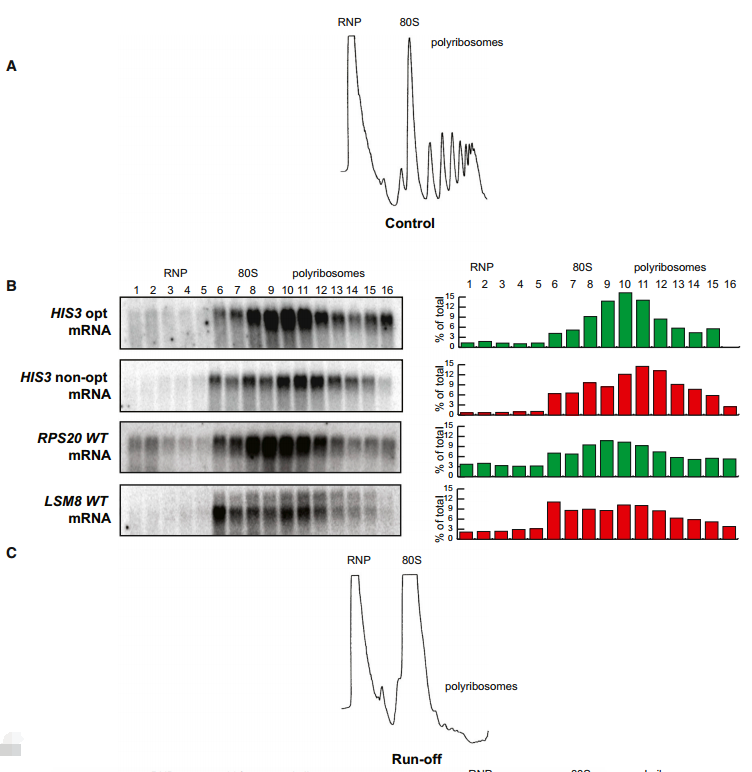
(C)径流条件下蔗糖密度梯度分析的代表性A260痕量,显示多核糖体组分崩塌。
为了监测核糖体流失,我们在葡萄糖剥夺前后提取mRNA-核糖体复合物,用蔗糖梯度分离材料,收集级分,并通过northern分析监测每个级分中HIS3 mRNAs的存在。重要的是,在正常条件下,确定HIS3 opt和非opt构建体的核糖体占有是相似的(图6B);然而,在诱导核糖体流失时,大部分最佳构建体mRNA重新定位到无核糖体区域的梯度顶部,而HIS3非opt mRNA仍然主要与多聚核糖体结合(图6D)。
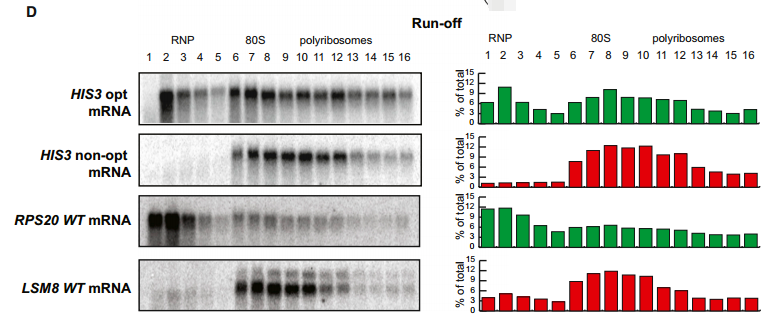
我们将这种分析扩展到密码子优化性显著不同的两种内源性mRNA转录物,LSM8 (45%最佳密码子)和RSP20 (92%最佳密码子)。值得注意的是,内源性LSM8 mRNA在翻译起始抑制后保留在多聚核糖体上,而RPS20 mRNA有效解离。我们认为保留率的差异是由于具有高最佳密码子含量的信息上更有效的核糖体易位。因此,在多核糖体组分中保留主要带有非最佳密码子的mRNAs表明密码子的最佳性可以直接影响核糖体易位的速率。
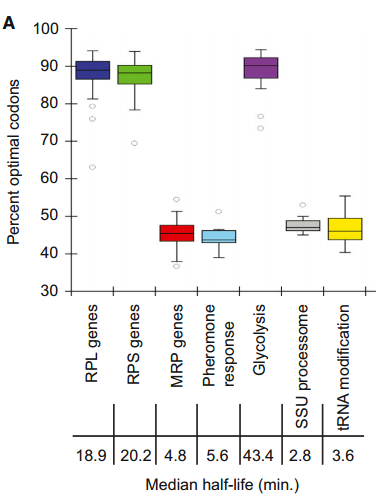
先前对酵母中mRNA稳定性的分析表明,一些编码在相同途径中起作用或属于相同复合物一部分的蛋白质的mRNA的衰变速率是相似的。单个mRNAs的更新似乎是基于它们编码的蛋白质的生理功能和细胞需求。我们假设,最佳密码子含量的调节可能为细胞协调表达共同功能蛋白质的转录物的代谢提供机制。我们评估了蛋白质产物在共同途径和/或复合体中发挥作用的基因的密码子使用情况。我们观察到,编码糖酵解相关酶的mRNAs(n=10)具有相似的和非常高的最佳密码子比例(平均值=86%;图7A)。这些转录本在之前和我们的全基因组分析中都被确定为稳定的(中位数半衰期=43.4min)。相反,编码参与酵母细胞信息素反应的多肽的mRNAs(n=14)都是不稳定的(中位半衰期=5.6min),平均只有43%的最佳密码子(图7A)。我们的分析显示,其他成绩单的表现类似。稳定的大和小核糖体亚基蛋白mRNAs(n=70和54,中位半衰期分别为18.9min和20.2min)平均最适密码子含量分别为89%和88%,但编码线粒体中核糖体蛋白的mRNAs不稳定(n=42,中位半衰期=4.8min),与观察到的45%最适密码子含量一致。(图7A和图B)。
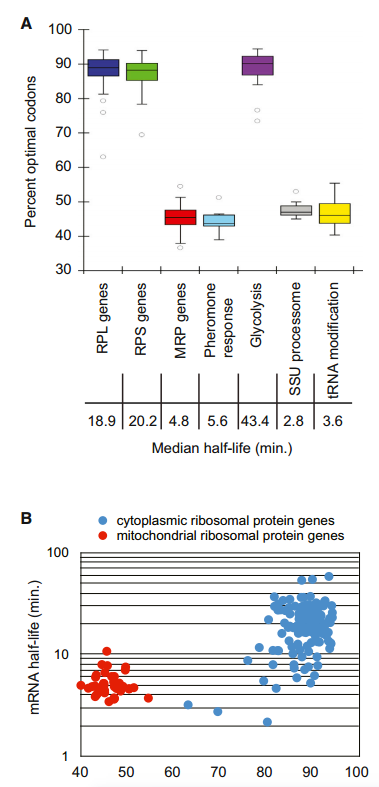
(A)其蛋白质产物具有相关功能的基因组被绘制出来以显示它们的最佳性。一半的数据属于盒装部分,而胡须代表其余的数据。四分位数距离下降1.5倍以上的数据点被视为异常值。代表的基因群包括70个大核糖体亚基蛋白基因、54个小核糖体亚基蛋白基因、42个线粒体核糖体蛋白基因、14个信息素反应基因、10个糖酵解酶基因、15个小亚单位加工小体基因和12个tRNA加工基因。
(B)细分两组,以显示最佳密码子含量与组内半衰期之间的关系。细胞质核糖体和线粒体核糖体中每种蛋白质的信使核糖核酸半衰期与该信使核糖核酸的最佳密码子含量相对应。
具有类似衰减率的其他基因家族包括那些其蛋白质产物参与核糖体加工、tRNA修饰、TCA循环、RNA加工和翻译机制组件的基因(图7和未显示的数据)。这些数据提供了证据,表明表达相关功能蛋白质的转录本在最佳密码子含量和衰减率水平上是协调的,这表明这些基因可能已经进化出特定的密码子内容作为一种机制,以促进基于它们在细胞中的功能的精确同步表达。
我们已经提供了几条证据表明密码子的最佳性是芽殖酵母中信使核糖核酸稳定性的主要决定因素。首先,生物信息学分析表明,最佳密码子的百分比与信使核糖核酸半衰期之间存在很强的相关性。例如,具有低于40%最佳密码子的mRNAs的中位半衰期为5.3分钟。而具有超过70%最佳密码子的mRNAs的中位半衰期为20.1min。从生物信息学中得出的结论得到了实验验证,表明将最优密码子改变为非最优不稳定的mRNA,而将非最优密码子改变为最优稳定的mRNA,否则不稳定。最重要的是,我们提供了最优和非最优密码子通过调节翻译延伸率发挥作用的证据。
几项核糖体图谱研究未能发现最佳密码子和非最佳密码子翻译中特定密码子的差异。然而,当编码相同多肽的mRNAs由最佳密码子或非最佳密码子组成时,我们观察到核糖体清除方面的显著差异。这些差异可能反映了许多小核糖体在非最佳密码子上的犹豫不决的加性效应。在核糖体图谱分析中,这种犹豫是不可察觉的。或者ORF的整体密码子组成可以设置整个ORF的统一的翻译延伸率。如果这是真的,核糖体图谱就不会检测到单个密码子的速率变化。
值得注意的是,虽然密码子含量显然是mRNA稳定性的主要决定因素,但它并不能预测所有mRNAs的半衰期。例如,几种组蛋白成分的信使核糖核酸,如HHF2和HHT1,含有85%的最佳密码子,但非常不稳定,半衰期分别为2.4和3.5分钟。这种mRNAs的半衰期可以由它们高效(或低效)启动翻译的能力和/或由5'或3' UTRs中的元件决定。每种方法都有大量的例子被描述。开放源码框架内的特征也可能解释一些异常值(例如优化和非优化密码子的分布)。
由于最佳密码子含量对翻译延长率的影响,很可能是某些因素(S)在mRNAs与核糖体接触时监控这些速率。事实上,我们之前已经表明,通过插入稀有密码子来减缓核糖体的运动会促进mRNA的降解。监测因子的主要候选是DEAD-box RNA解旋酶DHH1,它是mRNA衰变机制的一个组成部分,已被证明通过促进翻译抑制的作用作为脱帽的激活剂。翻译延伸率影响信使核糖核酸衰变的机制还需要进一步研究。
长时间尺度和短时间尺度都为细胞内密码子最佳性的重新分配提供了重要机会。在短期内,细胞生长条件和营养可获得性的变化可能显著影响单个(或部分)带电tRNA水平。这种供应减少的结果是,由于周转增加,富含在这些tRNA解码的密码子中的mRNAs的翻译延伸速度将减慢,其水平将下降。通过这种方式,密码子最优化不仅为细胞提供了磨练mRNA水平的一般机制,也为细胞提供了感知环境条件和快速定制基因表达的全球模式的机制。
长期的遗传变化可以将同义突变引入蛋白质编码基因,这些突变不会改变编码多肽的氨基酸序列;然而,如果突变显著改变了信使核糖核酸开放阅读框架内最佳密码子的比例,这种变化将影响信使核糖核酸和蛋白质表达水平。因此,同义基因突变可以被设想为一种进化对细胞有利的信使核糖核酸稳定率的方法。我们发现,编码蛋白质的mRNAs在相似的路径上共同作用,或者是相同化学计量复合体的一部分,并且以前被观察到以类似的速度降解,编码几乎相同比例的最佳密码子(图7A)。
我们认为,密码子的最优化已经针对这些基因集进行了微调,作为一种优雅的机制,以确保转录后协调调节和蛋白质在细胞所需的精确水平上的简约表达。有趣的是,相似水平的最佳密码子和非最佳密码子不仅可以确保相关mRNAs的稳定性和翻译率的相似性,而且还可以确保对tRNA水平变化(例如营养可获得性、胁迫、细胞类型等)的反应协调。最近的研究表明,细胞内的tRNA浓度不是静态的,而是不断地发生变化,有时是戏剧性的。例如,大规模RNA图谱实验表明,tRNA浓度在增殖细胞和分化细胞之间差异很大。根据我们的分析,我们认为tRNA浓度的显著变化可以通过动态改变mRNA的稳定性来改变细胞内的mRNA表达谱,即使转录没有任何变化。
最后,我们的工作表明,核糖体的共翻译mRNA监控不仅对快速降解异常mRNA很重要,而且对调节正常mRNA的降解速率也很重要。在真核生物中,mRNA的异常导致异常翻译事件,如过早终止、翻译终止缺失和核糖体停滞,这分别通过无意义介导的、Non-Stop和No-Go降解途径导致mRNA的加速周转。我们发现正常mRNA中的密码子使用也影响翻译核糖体,并对mRNA的稳定性有深远的影响。因此,核糖体作为主传感器,通过调节其延伸和/或终止过程,帮助确定所有正常和异常mRNAs的命运。使用核糖体作为传感器是蛋白质编码基因的理想选择,蛋白质编码基因在细胞中的主要功能是翻译。我们认为,mRNA稳定性的一个组成部分作为密码子组成的一个功能被构建到所有的mRNA中。翻译核糖体的延伸速率被传递给一般的降解机制,这影响去腺苷化和脱帽的速率。单独来说,一个mRNA中密码子的同一性预计对整个核糖体的解码有微小的影响;然而,在一个完整的mRNA框架内,我们发现密码子优化对翻译延伸和mRNA更新有深远的影响。因此,我们得出结论,密码子同一性代表了mRNAs的一个普遍性质,并且是它们稳定性的一个关键决定因素。
PDF原文下载链接1:
Codon optimality is a major determinant of mRNA stability或者2:
Codon optimality is a major determinant of mRNA stability



